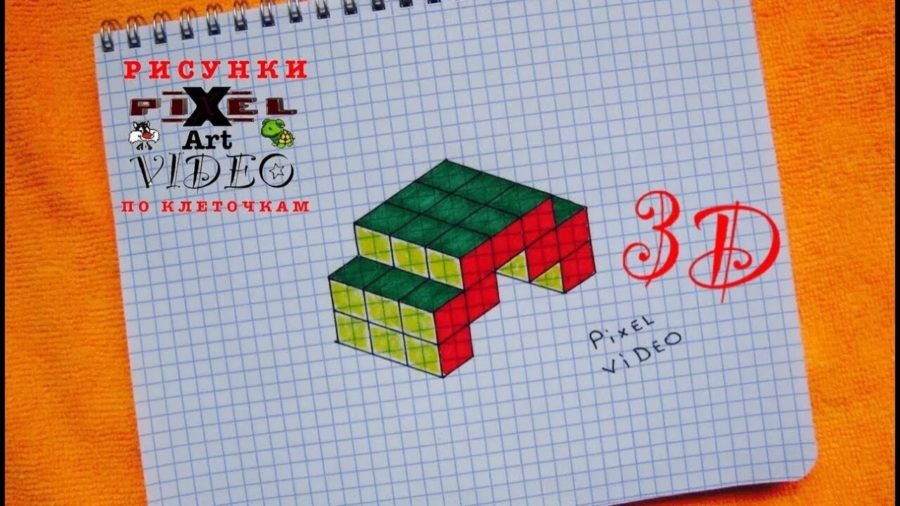
Схемы для плетения браслетов из бисера
Мода циклична, и сейчас «фенечки» возвращаются.
Далее рассмотрим схемы плетения фенечек из бисера.
Увидев сложные переплетения узоров, замысловатые формы и неповторимые цветовые сочетания, начинающим такое творчество покажется сложным. С помощью несложной теории и увлекательной практики вы поймете, что все выполнимо. Воспользуйтесь схемами плетения для изготовления браслетов из бисера своими руками.
Материалы для плетения
Работа с бисером проста и в то же время начинать, требуется с определенной подготовки и наработки навыков.
Для плетения браслетов из бисера и бусин, а так же лески или нити в первую очередь нужно подготовить необходимые материалы:
- Бисер. Должен быть хорошего качества и идеальной калибровки. В миниатюрных изделиях любые недочеты сразу будет видно. Рекомендую для любых техник использовать для украшений чешский бисер Preciosa за его исключительные качества.

- Леска, проволока, мононить или армированная нить. Выбор материала зависит от предпочтений мастера и удобства использования в работе.
- Игла. Для бисероплетения выбирайте длинные тонкие иголки.
- Необходимая фурнитура. Это застежки, подвески, коннекторы, дополнительные компоненты.
- Кусачки, круглогубцы. Пригодятся при работе с проволокой.
Виды браслетов
Следуя инструкции вы можете сделать для себя необыкновенный, широкий браслет на руку из бисера по схемам плетения. Рассмотрим самые трендовые варианты, далее разберем схемы плетения браслетов из бисера.
Браслет с именем
С помощью схемы рассчитываем количество бисерин необходимых для выбранной ширины и длины браслета. Возьмём среднюю ширину в 1,5 см. Приступим к плетению.
- Сложим леску пополам и нанизываем 3 бисерины. Через последнюю бусину протягиваем один из концов лески, туго затянем. Если плетем из бисера основного цвета, то набираем 2 штуки на правый кончик и 1 на левый.
- Правый кончик протягиваем через вторую бусинку. Так у нас образуется длина изделия.
- Чтобы сплести имя аналогично, но для этого используем второй цвет.
- Для более широкого изделия, нанизываем на леску 5 бисерин. При этом второй кончик лески нужно пропустить через пятую бусинку. Оба конца нитки в итоге должны появиться из 1 ряда и боковой бусины.
- На правый кончик добавляем две бисерины, а на левый – одну. Проводим сквозь неё правый кончик. Стороны изделия меняются местами. Леску пропускаем через весь первый ряд.
 Затягиваем.
Затягиваем. - Нанизываем по 1 бисеринке на все кончики нити. Правый кончик пропускаем через бисеринку слева с краю в предыдущем ряду. Затягиваем.
Для такого изделия можно подобрать или нарисовать любой рисунок украшения своими руками: цветы, символы, смайлы, также возможен мужской вариант браслета из бисера.
Браслет пружинка
Разберем, как сделать данный браслет из бисера.
Это самый простой, но и очень интересный вид браслета. С его плетением справится даже неопытный воспользовавшись схемой плетения браслета из бисера для начинающих.
«Многоэтажный» браслет, за идею взята пружинка в несколько витков. Он отлично подойдет рукодельницам, которые не хотят мучатся с застежкой. В качестве базы, вместо нити, для украшения на запястье используется проволока с памятью «Мемори». Особенность этой проволоки — прочность и упругость, способная удерживать нужную форму для руки.
Браслетик не разогнется и не распрямится, поэтому дополнительную фурнитуру и замочки можно не использовать.
- С помощью кусачек отрезаем 2-5 оборотов проволоки — на усмотрение мастера. Зажимаем один из концов проволоки круглогубцами и аккуратно сворачиваем петельку: она не даст бисеринкам слететь.
- Продеваем бисерины в произвольном порядке, при этом оставляем свободный конец в 2 см длиной. Тут не нужны схемы и сложности — только вообще воображение и фантазия.
- На втором кончике, так же делаем петельку круглогубцами.
Жгут
Это простые браслеты из бисера, схемы для которого, также подойдут новичкам в области бисероплетения. Следуя схеме плетения фенечки из бисера изделие получится объемным и интересным по фактуре. Когда приспособитесь, можно будет поэкспериментировать с формой, цветовыми сочетаниями и размером браслета. Для этого способа из материалов понадобятся иголка и нитка. Бисер лучше выбрать крупный, например 8/0.
- Фиксируем первую бусинку на нитке. Желательно закрепить нить так, чтобы она была в постоянном натяжении.

- На нитку иглой нанизываем 9 бисерин: пять белых для центра и четыре зелёных, для оплётки.
- Вытягиваем иголку в середине образовывая петлю.
- Набираем одну белую бусину и четыре зелёных.
Постепенно браслет из бисера образует круглую форму. Выплетаем до тех пор, пока изделие не станет похоже на ажурный жгут необходимой длины.
Крестик
Это одна из самых популярных техник бисероплетения. Считается, что только освоив это плетение можно пробовать силы на более сложных техниках. Браслеты из бисера в технике “Крестик” пошагово:
- Набираем 4 бусины и пропускаем нить через первую, потом плести по порядку через вторую и третью, образуя кольцо. Так получается первый крестик.
- Нанизываем следующие 3 бусинки и заводим леску в четвёртую у предыдущего крестика.
- Затягиваем леску.
- Формируем следующий крестик, и выводим кончик лески в верхнюю часть нового крестика.

- Повторяем до нужного размера. Получается неровная полоска из крестиков.
- Приводим форму в порядок, возвращаясь к самому началу.
- Заводим нить в боковую бисеринку первого крестика. Набираем 3 бусины и делаем новый крестик, выводя кончик лески в верхнюю часть последнего крестика.
- Нанизываем на основу 2 следующие бусины и пропускаем леску в боковую бусину второго крестика и верхнюю бисеринку предыдущего.
- Выпускаем нить через верхнюю и боковую бисерину нового крестика и боковую бисеринку третьего крестика.
- Плетение продолжается до края изделия и возвращается назад уже по второму ряду.
- Для регулирования ширины делаем третий, четвёртый, пятый ряд.
- Чтобы соединить концы крепим застёжку.
Украшение готово! Такой браслет из бисера своими руками сделать легко, а главное, подойдет для опытных и для начинающих рукодельниц.
Как сочетать цвета
Для гармоничного сочетания цветов в работе, можно воспользоваться цветовым кругом. Это простое и верное решение в подборе цветовой гаммы.
Запомним основные правила сочетания цветов:
- Сочетание 2 цветов. Эстетично смотрятся вместе комбинации родственных цветов, располагающихся рядом или противоположных, находящихся напротив друг друга на цветовом круге. Но важно помнить, что при составлении двухцветных сочетаний желательно использование цветов разной насыщенности и в разного количества.
- Сочетание 3 цветов. Идеально комбинируются два противоположных цвета и родственные к ним. Например, голубой и фиолетовый сочетаются с сиреневым цветом, состоящим из белого и фиолетового.
- Сочетание 4 цветов. Это только холодные или только тёплые оттенки. Не стоит перегружать цветом изделие.
Вдохновились? Пора пробовать и получать новые знания, теперь уже в области бисероплетения. Экспериментируйте, пробуйте, смотрите все возможные пошаговые мастер классы, уроки и сделайте самый оригинальные и красивые браслет из бисера, бусин, стекляруса и других украшений!
Экспериментируйте, пробуйте, смотрите все возможные пошаговые мастер классы, уроки и сделайте самый оригинальные и красивые браслет из бисера, бусин, стекляруса и других украшений!
Модель клеток растений — Etsy.de
Etsy больше не поддерживает старые версии вашего веб-браузера, чтобы обеспечить безопасность пользовательских данных. Пожалуйста, обновите до последней версии.
Воспользуйтесь всеми преимуществами нашего сайта, включив JavaScript.
Найдите что-нибудь памятное, присоединяйтесь к сообществу, делающему добро.
 Узнать больше.
)
Узнать больше.
)3D-культура клеток и изоляция клеток – 4Dcell
> Аннотация
В этом обзоре описываются традиционные и развивающиеся методы культивирования биологических клеток с акцентом на преимущества, которые методы 3D-культивирования клеток имеют по сравнению с их 2D-аналогами. Эти преимущества могут быть дополнительно достигнуты за счет интеграции микрофлюидных технологий с клеточными исследованиями, что дает беспрецедентный контроль над ключевыми параметрами клеточной культуры, такими как пространственные и временные градиенты клеточного микроокружения. Удержание клеток, целенаправленная изоляция и деформация небольшого количества клеток — это новый метод, который позволил использовать микрофлюидику, что еще больше расширяет области применения и потенциал микрофлюидных технологий, которые еще предстоит полностью реализовать в этой области исследований.
Эти преимущества могут быть дополнительно достигнуты за счет интеграции микрофлюидных технологий с клеточными исследованиями, что дает беспрецедентный контроль над ключевыми параметрами клеточной культуры, такими как пространственные и временные градиенты клеточного микроокружения. Удержание клеток, целенаправленная изоляция и деформация небольшого количества клеток — это новый метод, который позволил использовать микрофлюидику, что еще больше расширяет области применения и потенциал микрофлюидных технологий, которые еще предстоит полностью реализовать в этой области исследований.
> Введение
Чтобы полностью понять сложную форму и функции живых клеток, важно учитывать высокодинамичные характеристики клетки, такие как ее трехмерная структура, механические свойства и биохимическая среда [1]. Методы культивирования клеток in vitro уже давно являются жизненно важными исследовательскими и промышленными инструментами [2], используемыми для лучшего понимания клеточного поведения посредством многочисленных исследований, начиная от скрининга противораковых препаратов и заканчивая биологией развития [3]. Культуры клеток традиционно основывались на двумерных стеклянных, полистироловых или твердых пластиковых подложках; клеточные монослои, которые генерируют эти клеточные культуры на основе «чашек Петри», сильно ограничены их неспособностью реконструировать in vivo клеточного микроокружения и, таким образом, не являются репрезентативными для тех, которые обнаруживаются в организмах [1], [4]. В результате биологические реакции, измеряемые в 2D-исследованиях клеточных культур, такие как экспрессия рецепторов, миграция клеток и апоптоз, могут значительно отличаться от таковых исходной ткани или среды, в которой находятся клетки [3].
Культуры клеток традиционно основывались на двумерных стеклянных, полистироловых или твердых пластиковых подложках; клеточные монослои, которые генерируют эти клеточные культуры на основе «чашек Петри», сильно ограничены их неспособностью реконструировать in vivo клеточного микроокружения и, таким образом, не являются репрезентативными для тех, которые обнаруживаются в организмах [1], [4]. В результате биологические реакции, измеряемые в 2D-исследованиях клеточных культур, такие как экспрессия рецепторов, миграция клеток и апоптоз, могут значительно отличаться от таковых исходной ткани или среды, в которой находятся клетки [3].
Появление трехмерных клеточных культур было попыткой устранить ограничения двумерных клеточных культур [1] (см. рис. 1). Эти трехмерные клеточные культуры служат для имитации природного внеклеточного матрикса (ECM), высокогидратированной сети коллагеновых и эластических волокон, встроенных в гелеобразный материал из гликозаминогликанов, протеогликанов и гликопротеинов [5]. Они могут быть изготовлены с использованием природных и синтетических материалов в виде матриц или каркасов, чтобы лучше представить пространственную организацию клеточной среды [3], от которой зависит поведение многих клеток, тем самым уменьшая разрыв между клеточными культурами и культурами клеток. родные биологические среды [4], [6]. Следовательно, трехмерная культура клеток стала важным средством повышения актуальности клеточных исследований [7].
Они могут быть изготовлены с использованием природных и синтетических материалов в виде матриц или каркасов, чтобы лучше представить пространственную организацию клеточной среды [3], от которой зависит поведение многих клеток, тем самым уменьшая разрыв между клеточными культурами и культурами клеток. родные биологические среды [4], [6]. Следовательно, трехмерная культура клеток стала важным средством повышения актуальности клеточных исследований [7].
Появление технологии микрофлюидики в последние десятилетия еще больше расширило наши возможности для улучшения клеточных культур с более точным контролем локальной клеточной микросреды [8], [9]. Микрофлюидика, область, связанная с манипулированием небольшими объемами жидкости в геометрии микрометрового масштаба, часто на чипах на основе кремния, позволила получить множество преимуществ, применимых к клеточным исследованиям, таких как больший пространственный и временной контроль над микросредой [8]. , способность работать с меньшими объемами реагентов, иметь более короткое время реакции [10] и иметь больший потенциал для интеграции обработки клеток [9], [11]. Технология микрофлюидики также дает возможность удерживать клетки, благодаря чему небольшое количество клеток или даже одна клетка могут быть механически деформированы [12] или просто изолированы [13], что позволяет исследовать эффекты формы клеток и механических воздействий, а также как более целенаправленное понимание поведения клеток [14].
Технология микрофлюидики также дает возможность удерживать клетки, благодаря чему небольшое количество клеток или даже одна клетка могут быть механически деформированы [12] или просто изолированы [13], что позволяет исследовать эффекты формы клеток и механических воздействий, а также как более целенаправленное понимание поведения клеток [14].
Целью этого обзора является краткое изложение традиционных и микрожидкостных подходов к 3D-культивированию клеток и изоляции клеток, а также их значение для развития клеточных исследований.
> Основанные на матрице 3D-платформы для клеточных культур
Проблемы различия между 2D-культурой клеток и естественной средой клетки стали очевидны после того, как многочисленные исследования показали, что клеточное микроокружение вносит вклад в сложную пространственную и временную сигнальную область, которая направляет клетки. фенотип, при котором клетка определяется не только своим геномом, но и множеством других факторов, включая внеклеточный матрикс, факторы роста, гормоны и другие малые молекулы [15].
Трехмерные клеточные матрицы, или каркасы, представляют собой пористые субстраты, предназначенные для поддержки роста, пролиферации и дифференцировки клеток на их структуре или внутри нее (см. будет в естественных условиях [5]. Применение клеточных матриц можно разделить либо на клиническое моделирование, либо на методы in vitro . Клинические методы, такие как тканевая инженерия или регенеративная медицина, направлены на восстановление, сохранение или улучшение дефектных тканей человека с использованием искусственных 3D-матриц [16]. В таких случаях необходимо принимать во внимание механические свойства и свойства биоразлагаемости, что позволяет достаточно защитить форму структуры и засеянных клеток от нагрузок после имплантации, а также гарантировать, что материалы каркаса могут метаболизироваться в организме без серьезных токсических эффектов. 17]. Леса, разработанные для 3D in vitro моделирование направлено на системный анализ клеточной биологии, чтобы способствовать пониманию клеточной физиологии и патофизиологии [18]. В этом экспериментальном контексте трехмерная матрица должна быть спроектирована так, чтобы имитировать трехмерную организацию и функцию любой клеточной микросреды, которую экспериментатор пытается смоделировать, с дальнейшим вниманием к доступности матрицы для инструментов визуализации и анализа [5].
В этом экспериментальном контексте трехмерная матрица должна быть спроектирована так, чтобы имитировать трехмерную организацию и функцию любой клеточной микросреды, которую экспериментатор пытается смоделировать, с дальнейшим вниманием к доступности матрицы для инструментов визуализации и анализа [5].
Ключевой аспект конструкции, общий как для клинических, так и для in vitro приложений клеточного матрикса — это макро- и микроархитектура матрикса, охватывающая размер и геометрию пор матрикса, пористость, взаимосвязанность пор и топологию поверхности [19]. Высокие площади поверхности этих пористых структур позволяют клеткам врастать и закрепляться, а также транспортировать жидкости и питательные вещества. В зависимости от типа культивируемых клеток или тканей микропористость каркаса может быть важна для роста капилляров и взаимодействия между клеткой и матриксом, в то время как макропористость структуры важна для транспорта питательных веществ и отходов клеточного метаболизма [3].
Клеточные матрицы могут быть изготовлены с использованием как природных, так и синтетических материалов, обычно в форме гидрогелей, сшитых сетей с высоким содержанием воды, которые показали высокую эффективность в этом применении [15]. Полимерные материалы природного происхождения, такие как коллаген, фиброин, хитозан, альгинаты и крахмал, были первыми биоматериалами, использованными для культивирования клеток [21], и часто демонстрируют хорошие свойства биосовместимости и биоразлагаемости, хотя различия между партиями и сложность обработки некоторых полимеров являются существенными. заметные недостатки [19], [22]. Синтетические полимеры, такие как полигликолевая кислота (PLG) и полимолочная кислота (PLA), хотя, как правило, менее биосовместимы, чем их природные аналоги, дают возможность лучше контролировать ключевые характеристики, такие как отношение поверхности к объему, пористость и механические свойства [19]. , [22]. Несмотря на явные преимущества, которые трехмерные клеточные матрицы привнесли в методы культивирования клеток, они по-прежнему не могут полностью достичь пространственно-временных градиентов химических веществ и кислорода или механически активных микроокружений, которые являются одними из ключевых характеристик клеточных сред [1].
> Микрофлюидные 3D-платформы для культивирования клеток
Интеграция технологии микрофлюидики с клеточной биологией позволила беспрецедентно контролировать пространственные и временные градиенты химических веществ и кислорода в клеточном микроокружении, которые определяют поведение клетки — возможность адаптации переменных в микромасштабе, чего нельзя достичь с помощью обычных моделей клеточных культур [8], [9]. Эти микрожидкостные устройства, разработанные для приложений клеточной биологии, объединяют трехмерный анализ клеточных культур с методами микропроизводства, используемыми в производстве микрочипов [1]. Поли(диметилсилоксан) (PDMS), материал на основе кремния, является наиболее популярной средой для исследования микрофлюидных клеточных культур, часто изготавливаемой в виде небольших чипов с микроканалами с использованием мягкой литографии [9].]. Точный контроль клеточной микросреды может быть достигнут за счет использования микрожидкостных сетей для транспортировки химических веществ, питательных веществ и кислорода с определяемой пользователем скоростью потока, а также за счет манипулирования процессами микропроизводства и микропаттерна чипа для управления взаимодействием клеток и ВКМ и сдвигом. силы, действующие на клетки [11]. Микрофлюидный подход также приносит с собой практические преимущества, заключающиеся в возможности работы со значительно меньшими образцами, что потенциально снижает стоимость клеточных исследований и позволяет легко интегрировать стандартные аналитические операции в систему [14], [23].
силы, действующие на клетки [11]. Микрофлюидный подход также приносит с собой практические преимущества, заключающиеся в возможности работы со значительно меньшими образцами, что потенциально снижает стоимость клеточных исследований и позволяет легко интегрировать стандартные аналитические операции в систему [14], [23].
В то время как большая часть прогресса в этой области связана с демонстрацией доказательств концепции, относящейся к различным микрофлюидным геометриям и платформам [9], [23], был разработан ряд микрофлюидных систем, в том числе с приложениями для разработки биосенсоров, скрининг на наркотики, исследование стволовых клеток и генетический анализ [11]. Прогресс в микрофлюидной 3D-культуре клеток также был продемонстрирован при моделировании ECM для поддержки 3D-роста клеток и изучения миграции клеток, важного свойства живых клеток, влияющего на эмбриогенез, заживление ран, иммунный ответ, развитие тканей и болезненные процессы, такие как рак. метастазирование и воспаление [24]–[27]. Было показано, что эти микрожидкостные анализы миграции клеток обеспечивают точную миграцию клеток с ограниченным количеством реагентов, преодолевая при этом некоторые недостатки традиционных двухмерных анализов миграции клеток, такие как потенциальное повреждение клеток с помощью методов соскоба клеток и непригодность масштабирования таких моделей. к высокопроизводительному скринингу [24].
Было показано, что эти микрожидкостные анализы миграции клеток обеспечивают точную миграцию клеток с ограниченным количеством реагентов, преодолевая при этом некоторые недостатки традиционных двухмерных анализов миграции клеток, такие как потенциальное повреждение клеток с помощью методов соскоба клеток и непригодность масштабирования таких моделей. к высокопроизводительному скринингу [24].
> Удержание клеток
Новая возможность, появившаяся благодаря интеграции микрофлюидов с клеточной биологией, называется удержанием клеток, включающим как механическую деформацию отдельных клеток, так и изоляцию клеток. Микрожидкостные устройства использовались для выделения отдельных клеток в каплях размером в нанолитр и пиколитр, что значительно увеличивало концентрацию клеток. Это позволяет быстрее накапливать молекулы, высвобождаемые клеткой, без необходимости стадии преинкубации, что приводит к быстрому обнаружению бактерий [13], [29].]. [30] ]. Клеточная изоляция использовалась для ряда различных клеточных приложений, включая, например, исследования взаимосвязи между клеточным цитоскелетом и клеточной полярностью [31], поведения миграции клеток в условиях изоляции [32], механических свойств раковых клеток [12], клеточных разделение [33] и безметочное распознавание специфических клеток на основе их деформируемости [34]. Методы удержания клеток, используемые в этих исследованиях, варьирующиеся от использования уникальных геометрий микрофлюидных каналов [31] [35] до оптических растягивающих устройств [12] и сил инерции [34], демонстрируют универсальность микрофлюидных технологий применительно к клеточной биологии.
Методы удержания клеток, используемые в этих исследованиях, варьирующиеся от использования уникальных геометрий микрофлюидных каналов [31] [35] до оптических растягивающих устройств [12] и сил инерции [34], демонстрируют универсальность микрофлюидных технологий применительно к клеточной биологии.
> Заключение
Таким образом, трехмерное культивирование клеток имеет значительные преимущества по сравнению с обычным двухмерным клеточным культивированием. Пространственный домен in vivo , в котором клетки встречаются в природе и который жизненно важен для биологической передачи сигналов, определяющих поведение клеток, не может быть надежно достигнут на клеточных монослоях, которые создаются в двумерных моделях клеточных культур. Хотя современные методы трехмерного культивирования клеток, а именно те, которые включают клеточные матрицы или каркасы, значительно улучшают методы двумерного культивирования клеток, им все еще не хватает способности воспроизводить ключевые аспекты клеточного микроокружения. Некоторые из этих аспектов, в том числе пространственные и временные градиенты химических и кислородных и механических раздражителей, могут быть решены с помощью технологии микрофлюидики, которая обеспечивает платформу клеточных культур с универсальными приложениями при интеграции с клеточной биологией. Это включает в себя новую возможность локализации клеток, дающую целенаправленное представление о последствиях деформации клеток и механических напряжений. Хотя многие исследования микрофлюидики в области клеточной биологии были только демонстрационными [9].], становится ясно, что существует большой потенциал для все более эффективных и практичных исследований поведения клеток за счет использования микрофлюидики.
Некоторые из этих аспектов, в том числе пространственные и временные градиенты химических и кислородных и механических раздражителей, могут быть решены с помощью технологии микрофлюидики, которая обеспечивает платформу клеточных культур с универсальными приложениями при интеграции с клеточной биологией. Это включает в себя новую возможность локализации клеток, дающую целенаправленное представление о последствиях деформации клеток и механических напряжений. Хотя многие исследования микрофлюидики в области клеточной биологии были только демонстрационными [9].], становится ясно, что существует большой потенциал для все более эффективных и практичных исследований поведения клеток за счет использования микрофлюидики.
> Ссылки
[1] D. Huh, G. A. Hamilton, and D. E. Ingber, «От трехмерной клеточной культуры до органов-на-чипе», Trends Cell Biol. , том. 21, нет. 12, стр. 745–754, 2011.
[2] М. Рави, В. Парамеш, С. Р. Кавия, Э. Анурадха и Ф. Д. Пол Соломон, «3D системы культивирования клеток: преимущества и приложения», Дж. Сотовый. Физиол. , том. 230, нет. 1, pp. 16–26, 2015.
Сотовый. Физиол. , том. 230, нет. 1, pp. 16–26, 2015.
[3] JW Haycock, Трехмерная культура клеток: обзор современных подходов и методов. , том. 695. 2011.
[4] F. Pampaloni, E.G. Reynaud и E.H.K. Stelzer, «Третье измерение устраняет разрыв между клеточной культурой и живой тканью», Nat. Преподобный Мол. Клеточная биол. , том. 8, нет. 10, pp. 839–845, 2007.
[5] Дж. Ли, М. Дж. Каддихи и Н. А. Котов, «Трехмерные матрицы клеточных культур: современное состояние», Tissue Eng Part B Rev , vol. 14, нет. 1, pp. 61–86, 2008.
[6] M. Vinci et al. , «Достижения в создании и анализе трехмерных функциональных анализов на основе опухолевых сфероидов для проверки целевых показателей и оценки лекарственных средств», BMC Biol. , том. 10, нет. 1, с. 29, 2012.
[7] Б. А. Джастис, Н. А. Бадр и Р. А. Фелдер, «3D клеточная культура открывает новые возможности в клеточных анализах», Drug Discov. Сегодня , т. 14, нет. 1–2, стр. 102–107, 2009 г..
14, нет. 1–2, стр. 102–107, 2009 г..
[8] И. Мейвантссон и Д. Дж. Биб, «Модели клеточных культур в микрофлюидных системах», Annu. Преподобный Анал. хим. , том. 1, стр. 423–449, 2008.
[9] Е. В. К. Янг и Д. Дж. Биб, «Основы микрофлюидной клеточной культуры в контролируемых микросредах», Chem Soc Rev , vol. 39, нет. 3, pp. 1036–1048, 2010.
[10] Д. Дж. Биб, Г. Менсинг и Г. М. Уокер, «Физика и приложения микрофлюидики в биологии», Annu. Преподобный Биомед. англ. , том. 4, pp. 261–286, 2002.
[11] J. El-Ali, P.K. Sorger, and K.F. Jensen, Cells on chips., Nature , vol. 442, нет. 7101, стр. 403–411, 2006.
[12] J. Guck et al. , «Оптическая деформируемость как неотъемлемый клеточный маркер для тестирования злокачественной трансформации и метастатической компетентности», Biophys J , vol. 88, нет. 5, pp. 3689–3698, 2005.
[13] S. Köster et al. , «Микрожидкостные устройства на основе капель для инкапсуляции одиночных клеток», Лабораторный чип , об. 8, нет. 7, стр. 1110–1115, 2008.
8, нет. 7, стр. 1110–1115, 2008.
[14] Х. Андерссон и А. Ван ден Берг, «Микрожидкостные устройства для целломики: обзор», Sensors Actuators, B Chem. , том. 92, нет. 3, pp. 315–325, 2003.
[15] М. В. Тиббитт и К. С. Ансет, «Гидрогели как имитаторы внеклеточного матрикса для трехмерных клеточных культур», Biotechnol. биоинж. , том. 103, нет. 4, стр. 655–663, 2009.
[16] Дж. П. Ваканти и Р. Лангер, «Тканевая инженерия: проектирование и изготовление живых замещающих устройств для хирургической реконструкции и трансплантации», Ланцет , об. 354, с. SI32-I34, 1999.
[17] GSD Hetal Patel, Minal Bonde, «Биоразлагаемые полимерные каркасы для тканевой инженерии», Trends Biomater. Артиф. Органы , том. 25, нет. 1, стр. 20–29, 2011.
[18] Л. Г. Гриффит и М. А. Шварц, «Захват сложной трехмерной физиологии тканей в лабораторных условиях», Nat. Преподобный Мол. клеточная биол. , том. 7, нет. 3, стр. 211–24, 2006 г.
[19] Д. Дж. Тобин, «Каркасы для тканевой инженерии и трехмерной клеточной культуры», Методы Мол. биол. , том. 695, нет. 2, pp. 213–227, 2011.
[20] J. Naranda et al. , «Каркасы polyHIPE полиэфирного типа с взаимосвязанной пористой структурой для регенерации хряща», Sci. Респ. , том. 6, нет. Февраль, с. 28695, 2016.
[21] Б. Дхандаютапани, Ю. Йошида, Т. Маекава и Д. С. Кумар, «Полимерные каркасы в тканевой инженерии: обзор», Int. Дж. Полим. науч. , том. 2011, нет. II, 2011.
[22] Ф. Дж. О’Брайен, «Биоматериалы и каркасы для тканевой инженерии», Матер. Сегодня , т. 14, нет. 3, стр. 88–95, 2011.
[23] А. Л. Пагириган и Д. Дж. Биб, «Микрофлюидика и клеточная биология: преодоление разрыва путем проверки и применения микромасштабных методов для клеточных биологических анализов», BioEssays , vol. 30, нет. 9, стр. 811–821, сентябрь 2008 г.
[24] F.-Q. Nie, M. Yamada, J. Kobayashi, M. Yamato, A. Kikuchi и T. Okano, «Анализ миграции клеток на чипе с использованием микрожидкостных каналов», Biomaterials , vol. 28, нет. 27, стр. 4017–4022, 2007.
Kikuchi и T. Okano, «Анализ миграции клеток на чипе с использованием микрожидкостных каналов», Biomaterials , vol. 28, нет. 27, стр. 4017–4022, 2007.
[25] A. Valster, N.L. Tran, M. Nakada, M.E. Berens, A.Y. Chan и M. Symons, «Cell migration and инвазия assays», Methods , vol. 37, нет. 2, pp. 208–215, 2005.
[26] C. R. Justus, N. Leffler, M. Ruiz-Echevarria, and L. V Yang, «In vitro клеточная миграция и анализ инвазии», J. Vis. Эксп. , том. 752, нет. 88, с. e51046, 2014.
[27] N. Kramer et al. , «Анализ миграции и инвазии клеток in vitro», Mutat Res , vol. 752, нет. 1. С. 10–24, 2013.
[28] J. W. Hong, V. Studer, G. Hang, W. F. Anderson и S. R. Quake, «Процессор нуклеиновых кислот нанолитрового масштаба с параллельной архитектурой», Nat. Биотехнолог. , том. 22, нет. 4, pp. 435–439, 2004.
[29] J. Q. Boedicker, L. Li, T. R. Kline, and R. F. Ismagilov, «Обнаружение бактерий и определение их восприимчивости к антибиотикам путем стохастического удержания в нанолитровых каплях с использованием микрофлюидики на основе пробок. , Lab Chip , vol. 8, нет. 8, стр. 1265–1272, 2008.
, Lab Chip , vol. 8, нет. 8, стр. 1265–1272, 2008.
[30] G. Velve-Casquillas, M. Le Berre, M. Piel и PT Tran, «Микрожидкостные инструменты для клеточных биологических исследований», Nano Today , vol. 5, нет. 1. pp. 28–47, 2010.
[31] C. R. Terenna et al. , «Физические механизмы, изменяющие полярность и форму клеток в делящихся дрожжах», Curr. биол. , том. 18, нет. 22, стр. 1748–1753, ноябрь 2008 г.
[32] Г. Фор-андре, «Регулирование миграции дендритных клеток с помощью CD74, инвариантной цепи, ассоциированной с MHC класса II», Наука (80-. ). , том. 1705, нет. Декабрь 2008 г.
[33] С. М. Макфол, Б. К. Лин и Х. Ма, «Разделение клеток на основе размера и деформируемости с использованием микрофлюидных воронок-храповиков», Lab Chip , vol. 12, нет. 13, стр. 2369–2376, 2012.
[34] S. C. Hur, N. K. Henderson-MacLennan, E. R. B. McCabe, and D. Di Carlo, «Классификация и обогащение клеток на основе деформируемости с использованием инерционной микрофлюидики», Lab Chip , том.

 Затягиваем.
Затягиваем.